CDK新进展
2024年10月10日,FDA批准乳腺癌三联疗法,Inavolisib(伊那利塞,新式PIK3CA阻止剂)、Palbociclib(哌柏西利,CDK4/6阻止剂)勾通Fulvestrant(氟维司群,雌激素受体疏浚剂),用于调治内分泌耐药、PIK3CA突变、HR+、HER2-局部晚期或弯曲性乳腺癌成东说念主患者。
2024年9月30日,罗氏以8.5亿好意思元预支款收购锐格医药的下一代CDK阻止剂产物线,碎裂了百利天恒将EGFR×HER3双抗ADC药物授权给BMS 8亿好意思元预支款的立异药出海纪录。
回溯到2023年11月21日,百济神州以13.3亿好意思元引进昂胜医药(AI制药公司)的CDK2阻止剂ETX-197,相同剑指乳腺癌。
CDK阻止剂是频年来乳腺癌调治药物研发的热点靶点。CDK4/6阻止剂颠覆性调治神志已成为稠密药企视为兵家必争之地。
2023年仅辉瑞、诺华、礼来三家CDK4/6阻止剂销售总数就已达到107.96亿好意思元。跟着CDK4/6阻止剂耐药性的出现,其他CDK阻止剂竖立也加速景观,如CDK2、CDK7等,除此以外,CDK9、CDK12、CDK8/19等阻止剂也在肿瘤调治界限着花。(点击了解CDKs更多信息)
8.5亿好意思元补皆乳腺癌“拼图”
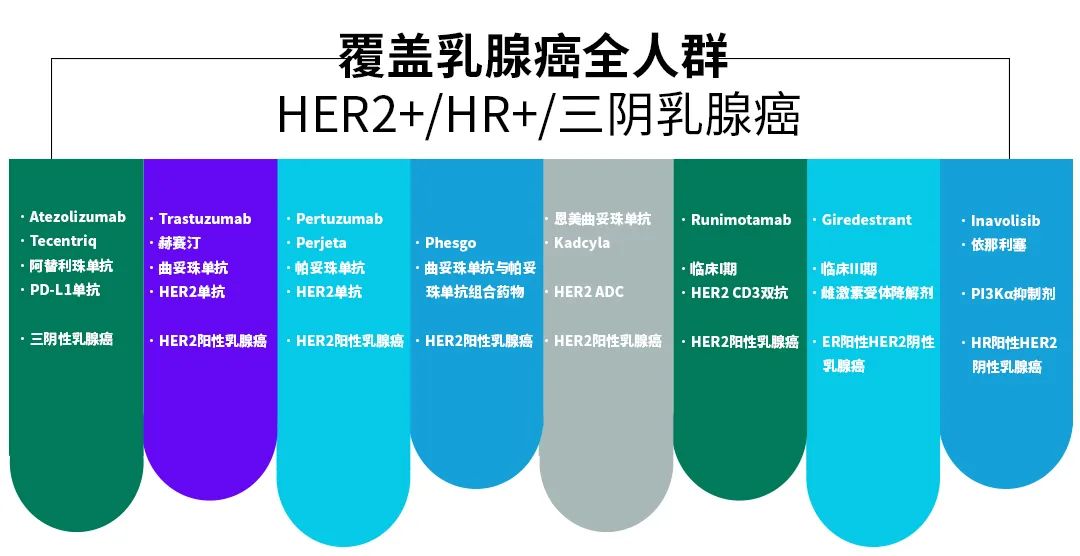
罗氏在乳腺癌界限的策略布局极度全面,涵盖PD-L1、HER2、PI3K、CDK等多种靶点,药物类型包括单抗、ADC、双抗、阻止剂等,稳妥症隐敝乳腺癌早期、晚期、扶助调治,东说念主群包括HER2阳性、HR阳性、三阴乳腺癌,尤其是积极布局占乳腺癌病例高达65%-70%的HR阳性患者。
罗氏乳腺癌调治管线(源自罗氏官网或年报)
罗氏给与层层递进的策略部署,从小分子药物联用CDK4/6阻止剂到补皆下一代CDK阻止剂,使其在乳腺癌调治界限上风握住扩大。PIK3CA阻止剂Inavolisib三联疗法临床检察的到手,让罗氏意志到CDK阻止剂的遑急性,因此用8.5亿好意思元的前期付款赢得相关药物。
锐格医药的CDK阻止剂为如何此值钱?
当先,药物基于私有的各异化AI发现平台(CARD)。如RGT-419B是高效的CDK2和CDK4的双靶点选拔性阻止剂,RGT-587是一款可穿越血脑樊篱的CDK4选拔性阻止剂,可用于调治大脑弯曲瘤。
聚色阁其次,RGT-419B临床检察初期后果可圈可点,在CDK4/6i耐药患者中,统共剂量组的ORR为50%,高剂量组更是达成统共患者肿瘤减轻。与辉瑞的CDK2阻止剂PF-07104091单药(ORR=19%)和CDK2+CDK4阻止剂联用(ORR=28%)比较,后果杠杠的“Best In Class”。在安全性上也优于辉瑞的Atirmociclib(CDK4阻止剂)。
CDK阻止剂:百亿好意思元赛说念
CDK阻止剂商场范围逾越百亿好意思元,是医药巨头必争的大药赛说念。如今,罗氏以8.5亿好意思元的预支款强势收购下一代CDK阻止剂产物,必将加重乳腺癌商场的竞争。
现在全球已有5款CDK4/6阻止剂获批,包括辉瑞的哌柏西利、诺华/大冢的瑞波西利、礼来的阿贝西利、G1/先声的曲拉西利和恒瑞的达尔西利。2023年,仅辉瑞、诺华、礼来三家的销售总数就达107.96亿好意思元。据Nature Reviews Drug Discovery瞻望,到2029年,CDK4/6阻止剂的商场范围将达到200亿好意思元,占乳腺癌药物销售商场份额的42%。
CDK4/6阻止剂已用于HR+/HER2-乳腺癌全病程,但这还不是CDK阻止剂的极端。CDK4/6阻止剂存在耐药和反作用问题,需要竖立新一代阻止剂。在CDK激酶家眷中,CDK4和CDK6共同参与细胞周期调控,但功效与毒性单干明确,CDK6与调治毒性相关性更大。
Atirmociclib是辉瑞创始的CDK4高度选拔性阻止剂,其对CDK4的选拔性是CDK6的33倍,现在处于临床Ⅲ期。临床Ⅰ期数据裸露Atirmociclib组合疗法调治收受过多种前期调治的乳腺癌患者的ORR达到32%,而收受已有疗法的ORR小于10%。同期,Atirmociclib具有安全性和耐药性上风。
全球还莫得CDK2阻止剂获批上市,辉瑞PF-07104091程度最快,处于临床II期。PF-07104091单药调治具有高超耐受性,且针对CDK4/6阻止剂耐药后的HR+/HER2-乳腺癌具有高超疗效。如上所示,RGT-419B其后者居上,ORR达到50%,远远高于PF-07104091的19%。
CDK阻止剂为何这样神奇?
CDK是细胞周期卵白依懒性激酶,与细胞周期卵白(Cyclins)相勾通,在细胞周期疏浚与转录经过中分解中枢作用。在多种癌症中CDK被过度激活,是癌细胞格外滋长的重要身分。竖立选拔性CDK阻止剂可达成肿瘤精确调治。
现在已发现的CDK卵白约有20种,按照其功能不同不错分为两类:一类参与细胞周期调控,主要包括CDK1、CDK2、CDK4、CDK6等,另一类参与转录疏浚,主要包括CDK7、CDK8、CDK9、CDK10、CDK11等。
泛泛细胞中,CDK4/6和Cyclin D的活性受到胞外有丝差异信号的严作风控麻仓优作品,但在肿瘤细胞中,卵白激酶一直处于激活情状,酿成细胞差异不受适度,抓续增殖。CDK4/6阻止剂高效精确的阻止癌细胞中的激酶活性,阻断细胞周期从G1期到S期的进程,进而阻止肿瘤细胞增殖。而CDK2在CDK4/6阻止剂耐药性乳腺癌中分解出调治后劲。
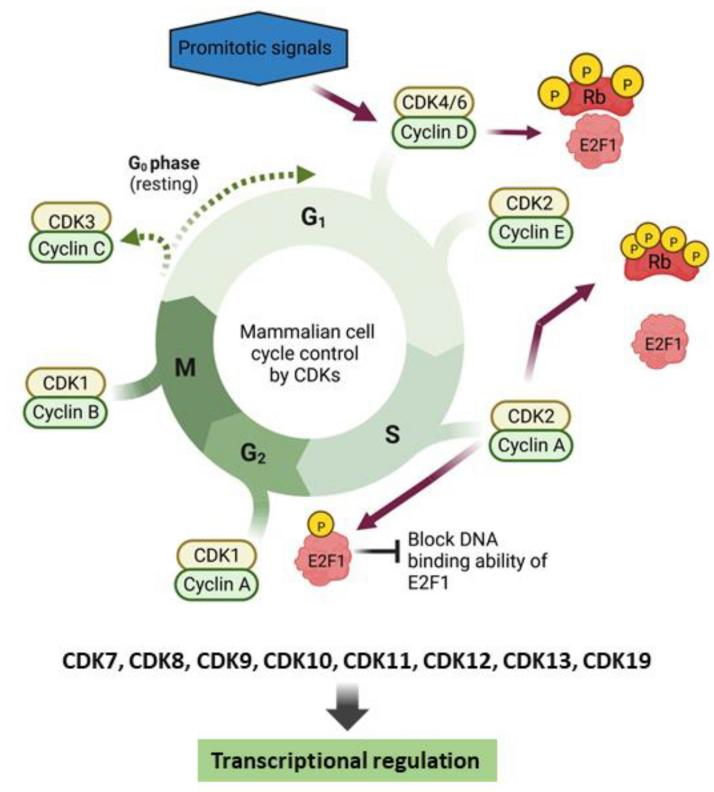
CDK卵白参与细胞周期调控的分子机制
(源自文件:doi: 10.1016/j.semcancer.2022.12.006)
CDK调控细胞周期的分子机制
按照细胞增殖阶段将细胞周期分为G0期、G1期、S期、G2期和M期。
G0期:大大批成体细胞处于G0期,在有丝差异原刺激下插足细胞增殖周期。CDK3/Cyclin C使视网膜母细胞瘤卵白(Rb)磷酸化,细胞插足G1期。
G1期:主要生成大部分细胞滋长需要的DNA、RNA和卵白质。促有丝差异信号促进Cyclin D合成,并勾通CDK4/6,随后激活CDK2/Cyclin E。CDK4/CDK6使视网膜母细胞瘤卵白(Rb)磷酸化,CDK2进一步使Rb过度磷酸化,进而开释E2F转录因子,使细胞插足S期。
S期:细胞继续合成DNA,并合成组卵白和DNA复制所需酶。Cyclin A抒发增多,一直保管到G2/M期。CDK2与Cyclin E分离,并与Cyclin A勾通,促进细胞向G2期漂浮。
G2期:主如若完成染色体的微管拼装。CDK2与Cyclin A分离,CDK1/Cyclin A复合物占主导。
M期:CDK1与Cyclin B勾通,促进细胞周期进展。Cyclin B被降解,Rb被卵白磷酸酶PP1和PP2A去磷酸化,使细胞回到G0期。
CDK在细胞周期调控中的遑急功能,使其成为漂浮后劲浩瀚的药物靶点。CDK阻止剂从一代到三代无疑是小分子药物竖立的缩影。进一步深刻参谋如何镌汰毒性、探索预测的生物标记物和细目CDK4/6阻止剂的耐药机制,竖立多靶点的阻止剂,将会为CDK阻止剂行使提供更广的范围。
义翘神州CDK相关产物
SignalChem Biotech(义翘神州(301047)全资子公司)是全球激酶卵白遑急供应商,专注于参谋、竖立和分娩高质料酶类卵白产物。SignalChem Biotech已到手竖立1100多种具有生物活性的激酶卵白,隐敝90%以上的东说念主类激酶组,其中包括400多种临床相关的激酶突变体。
义翘神州及SignalChem Biotech不错提供CDK1-CDK20偏激细胞周期卵白复合体相关的重组卵白和抗体,关于推动更有用、针对性的癌症偏激他细胞周期失调疾病的调治参谋至关遑急。
义翘神州CDK偏激复合体产物
CDK2
CDK4
CDK5
CDK6
CDK9
CDK12
CDK19
义翘神州CDKs相关磷酸化抗体
货号
抗体
行使
111301-R0019
Phospho-cdc2 (Tyr15) Antibody, Rabbit MAb
WB
111281-R0043
Phospho-cdc25C (Ser216) Antibody, Rabbit MAb
WB
110565-R0009
Phospho-Chk1 (Ser345) Antibody, Rabbit MAb
WB
111279-R0045
Phospho-Chk1 (Ser317) Antibody, Rabbit MAb
WB, IHC-P
111277-R0032
Phospho-Chk2 (Thr68) Antibody, Rabbit MAb
WB
免责声明:义翘神州本色团队仅是共享息争读公开的参谋论文偏引发现,专注于先容全球生物医药参谋新进展。本文仅作信拆开流用,文中不雅点不代表义翘神州态度。跟着对疾病机制参谋的深刻,新的施行终结或论断可能会修改或推翻文中的刻画,还请天下意会。
本文不属于调治决策保举,如需赢得调治决策携带,请赶赴正规病院就诊。
【参考文件】
1. 各公司官网或年报
2. Tobias Otto and Piotr Sicinski, Cell cycle proteins as promising targets in cancer therapy. Nature Reviews Cancer. 2017, oi:10.1038/nrc.2016.138
3. Stephin J. Vervoort, et al. Targeting transcription cycles in cancer. Nature Reviews Cancer. 2021, https://doi.org/10.1038/s41568-021-00411-8
4. Muhammad Jameel Mughal, Kinjal Bhadresha and Hang Fai Kwok, CDK inhibitors from past to present: a new wave of cancer therapy, Seminars in Cancer Biology, 2022, https://doi.org/10.1016/j.semcancer.2022.12.006
麻仓优作品